Capacità de scambi catiònich

La capacità de scambi catiònich (despèss scurtada con CSC) a l’è la quantità de cation che pòden vèss scambiàa, esprèssa in cmol(+)/Kg de soeul succ, che on material, ciamàa scambiador, dotàa de proprietàa dE adsorbiment el pò trattegnì per scambi iònich. El scambi iònich a l’è vun di meccanismi principàj cont i quàj el terrén el tratten e ‘l ghe mètt a dosposizión aI piant e ai microrganismi di element compagn del calcio, del magnesio, del potàssi, del'azòto amoniacàl, e per quèst la CSC a l’è on ìndes de la fertilità chimica del terrén.
Adsorbiment catiònich
[Modifega | modifica 'l sorgent]| Per savenn pussee, varda l'articol Adsorbiment. |
L'adsorbiment o scambi catiònich a l’è on procèss reversìbil de superfice che ‘l succéd in su la superfice de contàtt infra on materiàl sòlid dotàa de proprietà de scambi, e 'na soluzion de saj.
In del terrén, el scambiadór a l’è rappresentàa de l’insèma di partìcol sòlid che gh’hànn di grandèzz minor de 0,1 μm, bon de fa el mestée di collòid idròfil elèttronegativ; quèj partìcol chì hinn comprés ind la class de la tessidura del terren de la tèrra crea e hinn rappresentàa perlopù de l’humus e di mineràj creós vèr e pròppi (montmorilloniti, vermiculiti, illiti, ecc.). Per di valór del pH alt, i fànn el lavorà di collòid elettronegativ anca i idròssid de fèr (goethite, lepidocrocite) e de allumini (gibbsite) e i mineraj creòs del grùpp de la caolinite, ma in condizioni ordinari quèj mineràj chì gh’hànn ‘na capacità de scambi catiònich bassìssima e laoren ‘me di collòid elèttropositiv. La superfice totàl di collòid elèttronegativ a l’è de sòlit ciamada complèss de scambi.
La soluzion di saj in del terrèn a l’è inveci l’acqua che l’impienìss i spazzi de mèzz del terrén e i saj mineràj deslenguàa denter; a l’è ciamada donca soluzion circolanta.
L'interazion infra i cation e ‘l complèss de scambi l’è rappresentada di fòrz de attrazion elettrostatica ch ‘a hinn minga specifich. In realtà, i catión deslenguàa denter ind la soluzion circolanta hinn idratàa, o ben gh’hànn intorna on strat pu o manc spèss de molécol de acqua; el spessor de quèll strat chì e ‘l numer càregh elèttrich fànn de manera che el scambi catiònich el faga la selezión di catión.
La capacità de scambi catiònich de on scambiadór la dipend soratùtt de la densità di caregh elèttrich negativ in su la superfice. L’origin de quèj càregh chì la pò vèss vuna de quèsti chì.
Collòid organich
[Modifega | modifica 'l sorgent]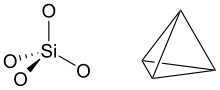
I caregh negatìv se originen de la spartizion di grupp funzionàj àcid, travèrs el slontanament de on ion idrògen. Di grupp funzionàj hinn per esempi tucc i grupp carbossilich (-COOH), e i grupp ossidril (-OH) di fenòl:
- -COOH → -COO- + H+
- -OH → -O- + H+
I proprietàa àcid de quèj grupp chì hinn pussée marcaa per i carbossìl, inveci i grupp fenòlich ciapen part a la formazion de caregh negatìv superciàj soratùtt per di valor elevàa del pH.
Mineraj creós
[Modifega | modifica 'l sorgent]
I caregh negatìv che gh’è in di mineràj creós pòden ‘vègh divèrsi origin:
- Presenza de ion ossidrìl in su la superfice de la graticola (ciamàa grupp idròssid de bòrd). L'element strutturàl di fillosilicaa (che infra de lor gh’è i mineràj creós) a l’è el tetraedro [SiO4]4- polimerizzaa cont on rappòrt Si:O di 1:2,5. In alter paròll, trii di caregh negatìv hinn neutralizzàa per mèzz de la condensa del tetraedro insèma de alter trii, cont el spartìss i ion ossìgen, inveci, la quarta l’è neutralizzada de la condensa del pian di trii tetraedri cont on pian ottaedrich de brucite o de gibbsite. De fianch di pian tetraedrich la polimerizzazión la se blòcca e inscambi de l’ossigen gh’è i grupp idròssid, che pòden spartìss e de conseguenza ingenerà di caregh elèttrich negatìv [1]:
- Sostituzion isomòrfa del silice con l'alumini ind el strat tetraedrich. La sostituzion de on tetraedro [SiO4]4- cont on tetraedro [AlO4]5- l’ingenera on eccèss de carega negativa che la pò vèss neutralizzada con di sostituzion isomòrfi invèrs in del pian ottaedrich, con l’adsorbiment o la fissazion di catión metallich o con la cloritizzazión, o ben la successión de on strat 2:1 cont on strat ottaedrich elèttropositiv. Ind on ambient fortement àcid quèj caregh chì hinn neutralizzàd di ion idrògen.
La densità di caregh elèttrich negativ la dipend, a bon cunt, de du fattór: la natura di caregh e ‘l pH del terren. In fonzión de la natura di càregh, la densità l’è relativament bassa se i caregh hinn originàa in prevalenza de la rottura di graticol cristallìn (es. caolinite), l’è in media alta a hinn originàa de on alt numer de sostituzion isomòrfi silicio-alumini (es. montmorillonite), l’è molto alta se hinn originàa de la spartizion ionica di grupp funzionaj organich (es. humus). De conseguenza la CSC a l’è in gener pussée alta in di scambiadór organich e pussée bassa in quèj mineràj e, quant ai collòid mineràj, l'è pussée alta in di mineràj creós ricch de sostituzion isomòrfi (vermiculiti, montmorilloniti) e pussée bassa in di fillosilicaa primari (Tabèlla 1). A gh’è poeu anca de dì che, in ambient àcid on quàj mineràl creós, compagn di caoliniti, el pò fà el lavorà di collòid elèttropositiv per via di sò proprietà molto anfòter di grupp idròssid e del bass grad di sostituzion isomòrfi de la graticola cristallina. Infra i scambiador mineràj, on comtèégn particolàr l'è quèll di zeoliti, 'na famiglia di tèttosilicàa: quèj mineràj chì gh'hànn 'na CSC compagna de quèll de l'humus e che la sortìss de la struttura particolar de de l'alt grad de sostituzion isomòrta infra el silicio e l'allumini.
| Tab. 1 - Gamma di valór de la CSC d’on quai scambiadór raportàd in letteradura | |||||
|---|---|---|---|---|---|
| Scambiatore | CSC (meq/100g) | Fonte | Scambiador | CSC (meq/100g) | Sorgent |
| Humus | 300-500 | [2] | Palygorskite[3] | 66-73 | [4] |
| Zeolite[5] | 200-400 | [6][7] | Halloysite[3] | 40-50 | [8] |
| Allofane[5] | 100-250 | [8][9] | Palygorskite[5] | 18-40 | [7][8] |
| Hectorite[3] | 145-165 | [4] | Illite[5] | 10-40 | [8] |
| Vermiculite[5] | 100-150 | [10] | Clorite[5] | 10-40 | [10] |
| Montmorillonite[5] | 80-150 | [4][7][10] | Caolinite[5] | 0-15 | [4][10] |
Corelazión tra el pH e la capacità de scambi
[Modifega | modifica 'l sorgent]A parità di condizion la reazion del terren la fa on lavorà fondamentàl: i collòid elettronegatìv del terrén, sia orgànich sia mineraj gh’hann di proprietà anfòter e fànn el mestée di àcid e di bas déboj. In di condizion tipich del pH del terren, l'humus e i mineraj creós fànn el lavorà di acid débol e, donca, di collòid elettronegatìv, inveci i idròssid de fèr e de alumini fànn el mestée di bas dèbol e, donca, di collòid elettropositìv:
- Tèrra crea-H + Me+OH- → Tèrra crea-Me+ + H2O
- Al-OH + X-H → Al-OH2+X-
Con la sbassada del pH el grad de spartizion di collòiod elèttronegativ el se sbassa, e ‘l tend vèrs el pont isoelèttrich, per quèst la densità de càrega negativa la se redùss parècc ind on ambient àcid. El ne sortìss che la CSC de on terrén o d’on qualsesia scambiadór la va su quand che ‘l pH el va su (la sbassada de la concentrazión di ioni H+ la spòsta l'equilibri vèrs sinistra) e la diminuìss con la sbassada del pH (l'aument de la concentrazione di ion H+ el spòsta l'equilibri vèrso drizza):
- Tèrra crea-Me+ + H+ → Tèrra crea-H + Me+
Valutazion de la CSC di terrén
[Modifega | modifica 'l sorgent]In del terrén la presenza di partìcol che gh’hànn di proprietà de scambi l’è domà ‘na part di tucc di granìtt de la tèrra crea, per quèst i valór de la CSC che se nòten hinn molto pussée bass. In quèj condizion chì la CSC a l’è determinada, oltra che de la natura del scambiador e del pH, anca del tenór de tèrra crea. La CSC, generalment al’è putòst bassa in di terreni minga compàtt, che ghe ‘n’hànn denter pòch de collòid, e in quèj di region tropicàj, de sòlit ricch de mineràj creós cont ona proprietà de scambi piscinina (caoliniti) e in pratega senza sostanza organica. La CSC la raggiòng di valór relativament alt in di terrén creós di zòn temperad, soratutt se hinn ben dotàa di mineraj di grupp de la vermiculite e della montmorillonite. Tuttamanch i valór pussée alt de la capacità de scambi catiònich hinn quèj di terrén dotàa de tanta sostanza organica, con di livèj estrèmmament alt in di terrén torbós.
La classificazión di terrén segond la CSC la ven raportada ind la tabèlla 2. Generalment di valor relativament alt, comprés infra 15 e 50 meq/100g se troeuven in di terrén creós dotàa de collòid che gh’hànn ‘n’alta capacità de scambi, inveci in di terrén de alt tenór de sostanza organica a se pòden superà anca i 100 meq/100g. Quèsti indicazion chì gh’hann tuttamanch domà on valór orientatìv perché tutt el discórs el dipend del tipo de collòid mineraj e, soprattùtt, de la reazión del terrén.
| Tab. 2 - Valutazion de la CSC di terrén[11] | ||
|---|---|---|
| Valutazion | CSC (meq/100g) | |
| Bassa | men di 10 | |
| Media | 10 - 20 | |
| Alta | de là de 20 | |
Determinazion de la CSC
[Modifega | modifica 'l sorgent]La determinazion de la capacità de scambi catiònich l'è 'na procedùra d’abitùdin de l'analisi del terrén. Quèll parametro chì, defàtt, el permètt di fà ‘na primma valutazion de la dotazion potenziàl di element nutriént del terrén e la mètt el fondament per tirà in pee ‘na giusta tècnica de ingrassadura, de manera de evità di fenòmen de mancanza e anca di pèrdit possìbil per slavaggiament e de conseguenza l'inquinament di àves.
El princippi in sul quàl la determinazion l’è fondada l'è la capacità de residuv bàsich d’on elettrolìt che 'l gh’hà dent on sal specìfich; in quèlla fase chì se doperen di procedùr standard ‘me per esempi la tamponada del pH a on cèrt valór de riferiment e el trattamént meccànic (agitazión, centrifugazión). In del cors del trattament el residuv bàsich del sal, che l’è fàa su de on catión, el ciapa el pòst di catión adsorbìd che vann in soluzión. In su l’estràtt che ‘l ven trattàa, vegnen fàa di determinazion specifich, compagn, per esempi, de la titolazion in volùmm d’on reagént dopràa che ‘l vanza, che permètten de trà foeura el valór de la capacità de scambi con l’aplicà i fórmol specifich del métod dopràa.
Ògni métod el gh’hà di errór sistematich che pòden falsànn l’interpretazión. I divèrsi métod, defàtt, fornìssen di risultàa divèrsi in fonzión de quèj fattòr chì:
- L'estrazion la trà via a la fàcil i bas de scambi, tuttamanch pòden vèssegh di difficoltà in del trà via i ion alumini e de conseguenza ‘na sòtastima de la CSC in di terrén àcid.
- La capacità de portà via del complèss di scambi la varia segond el sal dopràa.
- El trattament, in gener el pòrta a la solubilizzazion del calcàr, per mèzz de la formazión del bicarbonàa de calcio, Ca(HCO3)2, e , de conseguenza ona sorastima de la CSC in di terrén ricch de calcar.
- La determinazión la subìss l'influenza del pH in sul grad de spartizión di grupp idròssid de bòrd di fillosilicàa e la pò menà a ‘na sorastima di terrén acid.
Per quèj resón chì, el risultàa d’on'analisi el gh’hà de vèss semper compagnàa de l’indicazion del métod dopràa. Generalment i pòden vèssegh di errór ind l’interpretà i risultàa in di soeul molto àcid (sòtastima o sorastima) e in quèj ricch de calcàr (sorastima), inveci generalement hinn assée fidàbil i interpretazion fàa in sui risultàa ottegnùu per i soeul con ona reazión prèss a la neutralità, de già che ‘l sò tass de saturazion di bas a l’è assée elevàa e ‘l sò tenór de calcar a l’è moderàa.
I métod dopràa hinn fondà in su dò manér de frontà el problema :
- Tamponà el campion a on pH de riferimént: quèlla manera chì la considera minga l’acidità del terren, per quèst la pò falsà molto i risultà ottegnùu in su di terrén àcid e su quèj ricch de caolinite.
- Tamponà el campion al pH reàl del soeul de analizzà: quèlla manera chì a l’è in realtà ona stima indirètta perchè la detèrmina la CSC segond el calcio, el potassi e ‘l magnesio tràa foeura, tuttamanch la pò sòtastimà la CSC in del caso de elevàa tenór de l'alumini che ‘l pò vèss scambiàa (caso tipich di terrén àcid). Per determinà la CSC con pussée cura gh’è besògn de ‘n'analisi accessoria de manera de aplicà di fórmol de correzion che permètten de ottegnì de risultàa pussée fidàbil (capacità de scambi effettiva).
I métod pussée dopràa hinn du.
1. Estrazión per mèzz de l'acetaa d'amòni (CH3COONH4) con sistéma tamponàa a pH 7.
Quèll mètod chì l’è staa elaboraa del Chapman in del 1965[12]. A l'è el métod offizial in Italia,[13] e l’è adottaa ‘me métod offizial anca in tanti alter stat; in di Stat Unii d'America a l’è stàa dopràa tantìssim in del cors di decènni.
I vantàgg de quèll métod chì hinn soratùtt la disponibilità d’ona granda quantità de daa de riferiment e de la facilità de la soa aplicazion: ancabén el sìa putòst longh (circa 30 minùt) l’è util de vèss eseguìi in di laboratori de analisi e l’offrìss ‘na reperibilità discreta di risultàa, cont on errór màssim del 10%. De sorapù, l'estràtt el poò vèss poeu impiegàa per la determinazion quantitativa di bas de scambi (Ca, K, Mg e Na che pòden vèss scambiàa).
I svantàgg hinn soratutt du: el primm l’è associaa a ‘na sorastima de la CSC di terrén fortement àcid, el second l'è el fàa che l'acetaa amònich el mena in soluzión di quantità rilevant de calcio trà foeura de la frazion del calcàr. L'impiégh de quèl métod chì l’è nò consiliàa per i terrén alcalìtt che gh’hànn denter pussée del 50% de calcàr, per via d’on errór possìbil de misurazion alt.
2. Estrazion con clorur de bario (BaCl2•2H2O).
Quèll métod chì, che l’è raccomandàa de la Soil Science Society of America, gh’hà divèrsi variànt. La manera classica la prevèd l'estrazión cont ona soluzión tamponada a pH 8,1 de idròssid de bario in trietanolamina[14]. I variant impiegàa preveden l'estrazión per mèzz del clorur de bario in soluzion acquosa o in soluzion de trietanolammina con tampon a pH 8,1. Generalament a l'è on mètod che gh’è de laoragh tant adrée, per el quàl l’è necessari di pareggiadur specifich e de impiegà on reagént (el cloruro de bario) tòssich e assosènn inquinant. El vantagg a l’è però che ‘l pò vèss impiegà per la pupàrt di soeul e che ‘l pò vèss ripetùu. In sostanza a l’è on mètod pussée precìs de quèll de prima, bon anca per di misur che gh’hànn besògn de ‘na cura maggiora ma men preferìi d’abitùdin per i analisi. In di terrén alcalìtt, ancabén quèll mètod chì el traga foeura el calcio de la frazión del calcàr, l’offrìss on errór màssim pussée piscinin rispètt al métod de l’acetàa amònich.
Rappòrt tra CSC e podè tampon
[Modifega | modifica 'l sorgent]El complèss de scambi del terrén el rappresenta ona vasca di ion idrògen e de bas de scambi che ‘l fa interferenza cont i procèss che menen a l’acidità o a la alcalinità de manera de tend a fermaj. Quèll contégn chi el ghe dà la contrinuzion maggiora al podè tampón del terrén, ch'a l'è in di alter paròll la proprietà de mèttess contra di variazion del pH cont el neutralizzànn i càos.
La presenza de ion idrògen in del complèss de scambi la fa de manera che el terren el se mètta contra di agent responsàbil de l’alcalinità: l’aggionta d’ona bas ind la soluzion circolanta la fa de manera de dagh l’inviada a on equilibri de scambi, con l’adsorbiment del residuv bàsich in sul complèss de scambi e col rilàss di ion idrògen. In di alter paròll, in di condizioni che menen a l’alcalinità el complèss de scambi totàl el fa el mestée de l’àcid:
- Eror del parser (eror de sintassi): {\displaystyle [Collòid]\begin{matrix} - H \\ - H \end{matrix} + Ca^{2+} + 2OH^{-} \longrightarrow [Collòid]^{2-} Ca^{2+} + 2H_{2}O}
Vicevèrsa, la presenza di bas de scambi la fa de manera che el terrén el se mètta contra di agent che 'l menarissen a l'acidità: l'aggionta de on àcid ind la soluazion circolanta la ghe dà l’inviada a on equilibri de scambi con l’adsobiment di ion idrògen e ‘l rilass d’ona bas. In di alter paròll, in di condizion che menen a l’acidità, el complèss del scambi el fa el mestée de la bas.
- Eror del parser (eror de sintassi): {\displaystyle [Collòid]^{2-} Ca^{2+} + 2 H^{+} \longrightarrow [Collòid]\begin{matrix} - H \\ - H \end{matrix} + Ca^{2+}}
El podè tampón del complèss de scambi el finìss quand che la disponibilità di ion idrògen (che i ghe dànn contra a l'alcalinità ) e di bas de scambi (contra de l'acidità) i finìssen, per quèst la proprietà del podè tampon a l’è fortement correlada a la CSC totàl e al tass de saturazion di bas: el podè tampon el raggióng el sò màssim in di terrén cont on’alta capacità de scambi e cont on tàss de saturazion in basi de l’orden del 50%, e quèj condizion chì, generalment, gh’hinn in di terren creós, ricch de allofane, vermiculite, montmorillonite e, soratùtt, in di terrén ricch de sostanza organica e cont on pH moderatament àcid (pH 6-6,5).
In di terrén che ghe n’hànn pòch de collòid, ‘me quèj minga compàtt e quèj ricch de scheleter, la soa capacità de scambi bassa la ghe limita i proprietà tempón. I terrén molto àcid, de già ch'i gh’hànn ‘na capcità de scambi catiònich pussée bassa e, soratùtt, ‘na fòrta mancanza de bas de scambi, hinn assée suscettìbel e hinn fàcil a vegnì anmò pussée àcid, inscambi gh’hànn on podè tampon elevàa in di confront del’alcalinità. Al contrari, i terrén alcalìtt, de già ch'i gh’hànn on tass de saturazion di bas prèss al 100%, gh’hànn on podè tampon elevàa in di confront de l’acidità, ma hinn sucettìbel a l’aument ulteriór del pH.
Quèll contegn chì el spiega anca la difficoltà in del correg la reazion anormal de on terren dotà d’ona elevada capacità de scambi catiónich de già che ‘l complèss del scambi el manifèsta ona inèrzia vigorosa ind i confront di intervent de correzion.
Rappòrt tra CSC e tècnica agronòmica
[Modifega | modifica 'l sorgent]Segond a quant dìtt in precedenza a l’è evidént che la capacità de scambi catiònich la sia on fattór important per la feritilità del terrén. El complèss de scambi fa el lavorà del volìn chimich quand che el tass de saturazión di bas l’è minga del 100%: ona ingrassadura la ghe dà l’inviada a on equilibri de scambi cont el rilàss di ion idrògen ind la soluzión circolanta e l’adsorbiment del cation in sul complèss de scambi. El stèss cation el sarà protètt del slavaggiament e maneman rilassà ind la soluzion circolanta de manera de vèss a dispozion di piant, la tècnica agronomica la gh’hà de adattàss ai condizion reaj de manera de sfruttà i possibilità offèrt d’ona elevada capacità de scambi catiònica, vicevèrsa de scusà i lìmit d’ona capacità de scambi bassa.
Terren con bassa CSC
[Modifega | modifica 'l sorgent]I terreni con bassa CSC gh’hànn, in sostanza, pòch de nutrìent. In quèj terrèn chì i piant manifèsten pu o manc la mancanz de potassi, de calcio e de magnesio. Per di resón divèrsi ma contingént, i terrén cont 'na bassa capacità de scambi, gemeralment, gh’hànn pòch de azòto e de fòsforo: defàtt, ona bassa capacità de scambi l’è , generalment, compagnada de ona dotazion modèsta de sostanza organica, che che l'è assosènn util per trattegnì l’azòto in forma organica [15] e ‘l fòsforo, sia in forma organica sia in forma mineràl, adsorbii in sui collòid organich e in sui collòid elettropositìv.
La tecnica agronòmica la gh’hà de adattàss con el scusà la ridotta fertilità con l’ingrassadura. I ingrassadùr bondant pòden fa aumentà i pèrdit per slavaggiament de già che el terrén l’è nò pu bon de trattegnì ona quantità rilevanta de elemént nutriènt. I ingrassadùr gh’hànn donca de vèss moderàd e frequént s'a se voeruen doprà di ingràss mineràj. Inscambi, l'appòrt de quantititiv rilevant de materiàl organich, al fin de l’ingrassadura organica (quantità moderàd) o al fin del'emendamént (quantitàa elevàa) el gh’ha on grand effètt positìv, de già che 'l migliora la dotazion de element nutriént e poeu, con l'aggionta de l'humus el svolza el tenòr de collòid e, de conseguenza. la capacità de scambi catiónich. 'Na bona pratega agricola in di terrén sciòlt l’è donca el mèttegh el letàmm o, inscambi, l'appòrt de qualsessia ingràss orgànich. L’ingrassadura mineral l’è minga fondamentalment de dà indrée, tuttamanch la gh’hà de vèss fada in maera moderada e spantegada in del sors del temp al fin de evità di pèrdit per slavaggiament che darìssen sia on impàtt econòmich sia ambiental.
Terreni cont on'alta CSC
[Modifega | modifica 'l sorgent]I terrén cont on'alta CSC pòden vèss ricch de element nutriént, ma la valutazion la gh’hà de vèss semper raportada al tass de saturazion basica, che l’è on parametro che ‘l dipend soratùtt del pH del terrén.
Se la reazion l’è acida (pH < 5-5,5), anca in presenza de ona CSC alta la dotazion de element nutrient a l’è bassa istèss, soratùtt quèlla del calcio. El potàssi e ‘l magnesio pòden vèss present anca in di quantità discrètt, ma cont ona reazion del terrén fortement àcida ghe sarà anca la mancanza de quèj bas chì. L'azòto a l’è present in di quantità discrètt se el terrèn a l’è assée dotàa de sostanza organica, inscambi el fòsfro el podarìss mancà in resón del fàa che l’è nò movibil per resón chimcih. In quèj terrén chì l’ingrassadura mineràl l’appòrta di benefizi important de già che 'l complèss de scambi el ven ricch de bas. L'effètt, generalment el dura minga s’a se trànn minga via o se limiten nò i càos de l’acidità in sul longh tèrmen. On intervent de correzion insèma a ona ingrassadura de fond l’è bon de fa cress la fertilità di quèj terrén chì. Tuttamanch la rispòsta a l’ingrassadura l’è semper positiva soratùtt se vegnen fàa di somministrazion bondànt.
Se la reazion l’è nèutra o moderatament àcida (pH 6-7,5) el terrén el pò vègh on'ottima fertilità e l’offrìss ona possibilià de scèrna pussée granda. L’ingrassadura de fond la pò vèss necessaria se gh’è ona mancanza d'ona specifica bas de scambi, inveci quèlla de mantegniment l’è raccomandada al fin de conservà in del cors del temp di livèj de fertilità alt.
Se la reazion a l’è moderatament alcalina (pH 7,5-8,5) el terrén el gh’avrà on tass de saturazion basica elevàa, prèss al 100%. In quèj condizion chì la fertilità potenziàl l’è elevada, ma l’è sconduda per via del fàa che tanti nutriént hinn minga solùbil, in particolar el fòsforo e divèrsi microelemént. A pòden anca capità di mancanz de potàssi per via de l'antagonismo del calcio che ‘l se manifèsta sia al livèll de l’assorbiment di radìs, sia de l'assorbiment in su i collòid. Generalment quèj terrén chì gh'hànn besògn de furbarij particolar de manera de limità i procèss che fànn vegnì minga solùbil i element nutriént. La concimazión la gh'hà de vèss fada sòtt’oeugg, soratutt quant a l’appòrt de l'ingràss fosfatich, inveci di alter fenòmen de mancanza pòden vèss frontà cont l’ingrassadura travèrs i foeuj o con di alter furbarij tecnich (per esempi l’uso de portinèst che resisten al calcàr per la vìdor e ‘l per). L’ingrassadura potàssica l’è bona de dà di benefizzi important, ma generalment, in quèj terrén chì, l’è 'na bona usanza eseguì di intervent moderàa e cont ona cèrta frequenza, de già che i ingrassadùr bondànt pòden ‘vègh minga succèss. La correzion la fà minga el so lavorà de già che l'elevada CSC, el tass di saturazion di bas elevàa e l'elevàa tenór de calcàr attiv esàlten al màssim el podè tampón vèrs l’acidità.
Se la reazion del terren a l’è fortement alcalina (pH > 8,5) el terrén el gh’avarà on tass de saturazión basica del 100% e soprattùtt una percentual alta de sòdio che ‘l pò vèss scambià, con di conseguenz gravissim sia in su la fertilità chimica, sia in su quèlla fisica, fin anca a proibìghenn l’esercizzi medèsim a l’agricoltura. In quèj condizion chì l'elevada CSC l’è on difètt ver e pròppi de già che la fa diventà difficìl o anca del tutt impossìbil l’utlizzazion de quèj terrén chì.
Esempi prategh
[Modifega | modifica 'l sorgent]Al fin de capì l'importanza de la capacità de scambi el pò servìss fàa on confrónt sòta l’aspètt quantitatìv infra du divèrsi tipi de terrén.
Al fin de rappresentà on ambient òttim, sòta vari pont de vista, a pòdum fagh riferiment a on terrén de medi impàst, ben stratturàa e cont ona dotazion de tèrra crea moderada (20-25%), piazzàa ind on ambient mediterraneo e cont ona reazión nèutra. On terrén con quèj caratteristich chì el pò ‘vègh ‘na densità apparenta de l'órdin de 1,3 t/m3. S'a se mètt l’ipòtesi che ind la frazion creósa ghe sìen di mineràj del tipo di montmorilloniti e che la dotazión de l’humus la sia al limit de quèll che ‘l basta, la capacità de scambi la gh’avarà di valór medi o alti. L'analisi chimica la dà ‘na CSC di 25 meq/100g e on grad de saturazion basica del 75%. La dotazion di basi de scambi, riferida a la CSC, l’è spartida inscì: calcio 60%, magnesio 10%, potassi 5%.
Per rappresentàa un ambient minga òttimal, sòta vari pont de vista, a se pò fagh riferiment a on terren che ‘l tend al sabbiós, ricch de scheleter, cont ona bassa dotazion de tèrra crea (men del 5%), piazzàa in don ambient mediterraneo e cont ona reazion àcida (pH 5). On terrén con quèj caratteristich chì el pò ‘vègh ‘na densità apparenta de l'ordin de 1,5 t/m3. Quèll terrén chì a gh’è n’hà pòcch de collòid mineràj e, a caosa de la soa tessidura grossolana, l’è sogètt a perìod de brusècc e alt temperadur che ruzen el bilanc de la sostanza organica vèrs la mineralizzazion; per quèst la quantità de l' humus la sarà putòst bassa. L'analisi chimica la dà ‘na CSC de 4 meq/100g e on grad de saturazion basica del 30%. La dotazion de bas de scambi, riferida a la CSC, a l’è spartida inscì: calcio 5%, magnesio 15%, potassi 10%.
La prima operazion de fà l’è el calcolo de la massa del terrén (M) a la quàl i dàa gh’hànn de vèss raportàa, cont el ciapà in considerazion ‘na profondità de 40 cm (p) e ‘na superficie de 1 ha (S). A insegnà con da la densità apparenta e con V el volumm (in meter cubi), el càlcol el se fa con quèlla fórmola chì:
El coefficient 100 l’è aplicàa per esprìmm i longhèzz e i superfici per mèzz di unitàa de misura omogenui. A Indicà con A el terren del primm esempi e con B quèll del segond esempi, a sarà inscì:
MA = 40 • 1,3 • 100 = 5.200 t/ha
MB = 40 • 1,5 • 100 = 6.000 t/ha
La capacità de scambi totàl (esprèssa in gram equivalent per èttar) la ven ottegnuda per mèzz de quèlla formola chì:
El coefficient 10 el ven aplicà per esprìmm i mass con di unitàa de misura omogenui (tonnellàd in gram) e per trasformà i milliequivalént in equivalént. In del coefficient gh’è denter anca l’espression che la trasforma la CSC in tèrmen de percentuàl. In di du terrén la sarà:
CSCtA = 25 • 5200 • 10 = 1,3•106 eq/ha
CSCtB = 4 • 6000 • 10 = 0,24•106 eq/ha
A quèll ponto chì se pòden calcolà i dotazion di òssid del calcio, del magnesio e del potassi, esprèss in t/ha per mèzz de quèlla fórmola chì:
- .
Ind la fórmola, "x" l’indica la percentuàl de l'elemént in del complèss de scambi, "e" il pes equivalént de l'elemént (20 per el calcio, 12 per el magnesio, 39 per el potassio), "s" l’è el coefficient di conversión stechiométrich del stèss òssid (1,4 per el calcio, 1,67 per el magnesio, 1,2 per el potassi).
| Tab. 3 - Dotazion di bas de scambi in di du terrén de l’esempi (in t/ha) | |||
|---|---|---|---|
| CaO | MgO | K2O | |
| Terrén A | 21,84 | 2,60 | 3,04 |
| Terrén B | 0,34 | 0,72 | 1,12 |
Cont el mètt l’ipòtesi che in sti du terrén chì el vegna coltivàa el forment e semper quèll tucc i ann e senza ingrassadura, che in del prìmm terrén la ghe sia ‘na resa de 30 q/ha e in del segond de 10 q/ha, i risèrv de calcio finirissen in 1456 anni in del primo terreno e in 68 anni in del segond terrén. Cont on discórs compagn, i risèrv de potàssi finirissen 190 ann in del primm caso e 55 in del segond. Quèj càlcol chì, domà teòrich, hinn fondà in sul princippi che la produzion de 1 quintàl de forment el traga via 500 g de òssid de calcio [16] e 533 g de òssid de potassi [17].
Riferiment
[Modifega | modifica 'l sorgent]- ↑ In realtà la proprietà acida di grupp -OH de fianch di tèrr crea a l’è debolissima per via de la spiccada proprietà anfòtera de l'acqua e di grupp idròssid. Quèsti siti chì se spartissen domà cont on pH maggior de 7, per quèst in di terrén nèuter e in di terrén àcid ghe partècipen minga a la formazión di caregh negativ.
- ↑ Belsito et al. Op. cit., p. 283.
- ↑ 3,0 3,1 3,2 Minerale sensu stricto
- ↑ 4,0 4,1 4,2 4,3 S. Battaglia, L. Leoni; F. Sartori, Determinazione della capacità di scambio cationico delle argille attraverso l'analisi in fluorescenza X di pasticche di polvere (PDF), in Atti della Società Toscana Scienze Naturali, Memorie, Serie A, vol. 109, 2004, pp. 103-113. (archiviato dall'url originale il 28 settembre 2007).
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 Gruppo sensu lato
- ↑ Caratteristiche chimico-fisiche delle zeoliti (PDF). Life Ambiente 2002 Progetto "TreLaghi". URL consultad in data 16 agosto 2007.
- ↑ 7,0 7,1 7,2 Elio Passaglia. Zeoliti zeolititi e loro applicazioni, pp. 9. Università di Modena e Reggio Emilia, Dipartimento di Scienze della Terra. URL consultad in data 16 agosto 2007. (arqiviad de l'url orijenal in data 23 agosto 2007)
- ↑ 8,0 8,1 8,2 8,3 Belsito et al. Op. cit., p. 261.
- ↑ Mauro Sbaraglia; Lorenzo Sbaraglia. La capacità di scambio cationico nelle analisi pedologiche (PDF). Associazione Italiana Pedologi. URL consultad in data 16 agosto 2007.
- ↑ 10,0 10,1 10,2 10,3 Belsito; et al., Chimica agraria.
- ↑ L.F. Goldberg; E. Arduino, La valutazione della fertilità in Chimica del suolo, Pàtron.
- ↑ H.D. Chapman, Cation-exchange capacity in Methods of soil analysis - Chemical and microbiological properties. Agronomy 9 (in inglese), C.A. Black (ed.), 1965.
- ↑ Metodo Ufficiale n. XIII.1, Supplemento Ordinario della Gazzetta Ufficiale n. 248 del 21 ottobre 1999.
- ↑ (EN) A. Mehlich, Use of triethanolamine acetate-barium hydroxide buffer for the determination of some base exchange properties and lime requirement of soil, in Soil Sci. Soc. Am. Proc., vol. 29, 1938, pp. 374-378.
- ↑ La CSC ancasì la contribuiss direttament a trattegnì l'azoto amoniacàl, de già che ‘l ion amòni fa el mestée de la bas de scambi
- ↑ Giardini. Op. cit., p. 175.
- ↑ Giardini. Op. cit., p. 451.
Bibliografia
[Modifega | modifica 'l sorgent]- AA.VV, Paolo Sequi (a cura di), Chimica del suolo, Bologna, Pàtron, 1989.
- Luigi Giardini, Agronomia generale, 3, Bologna, Pàtron, 1986.
- Alda Belsito; et al., Chimica agraria, Bologna, Zanichelli, 1988.
- Andrea Giordano, Pedologia, Torino, UTET, 1999.
- G. Gisotti, Principi di geopedologia, Bologna, Calderini, 1988.
- Soil Survey Division Staff (a cura di), Soil survey manual (PDF) (in inglese), Soil Conservation Service. U.S. Department of Agriculture Handbook 18, 1993.
Vos correlad
[Modifega | modifica 'l sorgent]- Proprietà chimich del terren
- Adsorbiment
- Podè assorbent del terren
- Podè tampon del terren
- Reazion del terren
- Tass di saturazion di bas
- Bas de scambi
- Vocazion ambiental di piant
Ligamm de foeura
[Modifega | modifica 'l sorgent]- Donald S. Ross. (EN) Recommended Methods for Determining Soil Cation Exchange Capacity. URL consultad in data 5 settembre 2007. (arqiviad de l'url orijenal in data 8 agosto 2007)
- (EN) Cation Exchange Capacity (CEC) (PDF). Department of Crop and Soil Science, Oregon State University. URL consultad in data 2007-00-05.



