pH
| Quest articol chì l'è in la Vedrina de la Wikipedia |
El pH a l’è ‘na grandèzza fisica che l’indica l'acidità (oppur la basicità) de on gas e de on liquid.
El sìmbol "pH" a l’è staa inventà in del 1909 del chimich danés Søren Sørensen.[1]
Il tèrmen p (operadór) a l’è el sìmbol de dò operazion matemàtich in su l’attività del cation ossòni in soluzion acquosa: a se fa innanz el logaritm in base 10 de l'attività e poeu a ghe se mètt el sègn men denanz. Per i proprietà di logaritm, a s'ottèn el medésim risultàa anca cont el calcolà el logaritm del reciproch de de l’attività di ion ossòni.
Donca a se definiss inscì:[2] )
indoe aH+ la rappresenta l'attività di catión ossóni. L'attività di ión ossòni a l’è ‘na grandèzza senza unitàa de misura, defàtt a l’è definibil inscì in tèrmen de concentrazion molar di ion ossòni: )
‘doe a l’è la concentrazion molar di catión ossòni, l'è la concentrazion molar unitaria (misa dent domà per fa de manera che l’argoment del logaritm el sia senza unitaa de misura) e a l’è el coefficient molar de attivitaa, on parametro senza unitàa de misura che ‘l misura i deviazion de la condizion ideàl caosàd soratùtt di interazion elèttrostatich intrai ion in soluzion.
El coefficient de attività el tend a l'unità (e donca l'attivitàa la se vesina a la concentrazión molar di cation ossòni) per di soluzion acquos slongàd assée (≤ 0,1 mol/dm³). In quèj condizion chì, l'equazion de prima la pò vèss semplificada inscì:
Ancabén el sia minga giust del ponto de vista matematich, a l’è d’usanza, per resón de curtèzza, de tralassà l’indicazion de la concentrazion unitaria ind l’argoment del logaritm (ma cont el suppònn comunque la soa presenza) e scriv el pH domà in quèlla manera chì:
De convenzión, el pH di soluzion acquos l’assumm di valór infra 0 (acidità màssima) e 14 (basicità massima). La condizion de neutralità la corrispónd al valór de mèzz, 7, tipich de l'acqua pura a 25 °C.
El pH el poò vèss misuràa per via elèttrica, cont el sfruttà el potenziàl creàa de la differenza de concentrazion de ion idrògen in su i du lati de ‘na membrana de veder (vedée peaccàmeter), oppùr per via chimica, cont el sfruttà la capacità di quaj sostanza (ciamada indicadór) de cambià el sò color in funzion del pH de l'ambient 'ndoe l'è. De nòrma, chi sostanz chì hinn doperàd in soluzion, compagn per esempi de la fenòlftaleina e ‘l bloeu de bromotimòl.
Despèss i indicadór vegnen doperàa anca sora di band de carta ( i inscì ciamàd "cartinn indicadór universàl"), che cambien el sò colór quand che vegnen pocciàa denter in di sostanz àcid o basich. L’esempi pussée comun a l’è quèll di " tornasól", de colór roeusa in ambient àcid e azur in ambient alcalin.(
Acidità e basicità di soluzion acquos
[Modifega | modifica 'l sorgent]| Sostanza | pH |
|---|---|
| Acid cloridrich 1 M | 0 |
| Sugh gastrich | 1,0 – 2,0 |
| Coca Cola e succh de Limon | 2,5 |
| Asee | 2,9 |
| Succh de naranz | 3,7 |
| Birra | 4,5 |
| Pioeuva acida | 4,5 - 4,8 |
| Cafè | 5,0 |
| Tè e pèll sana | 5,5 |
| Acqua deionizzada a 25 °C | 5,5 - 6,0 |
| Acqua ossigenada | 6,2 |
| Latt ben conservàa | 6,5 - 6,7 |
| Acqua distillada a 25 °C | 7,0 |
| Saliva umana normàl | 6,5 – 7,5 |
| Sangh | 7,35 - 7,45 |
| Acqua de piscina regolàr | 7,2 - 7,8 |
| Acqua de mar | 7,7 – 8,3 |
| Bicarbonaa de sòdi | 8,31 |
| Savon alcalin | 9,0 - 10,0 |
| Amoniaca | 11,5 |
| Ipoclorii de sòdi | 12,5 |
| Lessiva | 13,5 |
| Idròssid de sòdi 1 M | 14 |
L'acqua distillada, (senza sal e sostanz vari, a differenza de quèlla del rubinètt o di bott'li) l’è minga on bon elèttrolit, cioè la mena nò la corrent elèttrica, de già che la gh’hà denter domà ona quantità piscinina de ion ossòni (con carega positiva) e ossidril ( on carega negativa), per via de la reazion de autoprotòlisi de l’acqua segond quèll equilibri chì:
Per i soluzion solngàd, ‘doe l’è giust tiràgh vesin l’attività ai concentrazión, la costanta de autoprotolisi a l’è eguàl del prodòtt di concentrazion di ion ossidril e ossòni:
El valór de Kw de l’acqua distillada a 25 °C e 100 kPa (condizion standard) a l’è pari a 1,0 x 10−14 M2.
Ind l'acqua pura a 25 °C la condizion de elettroneutralità combinada con l’equilibri de l'autoprotolisi l’impònn che la concentrazion di ion H3O+ e OH- che vegnen de la separazion de l’acqua de l’acqua la risulta
- [H3O+] = [OH-] = 1 × 10-7 M
corrispondenta al pH = 7, che l’indica la neutralità.
De già che la costanta de autoprotolisi la cambia insèma a la temperadura, quèlla concnetrazion chì la varia cont el varià de la temperadura, e per quèst i calcol l'è mèj che se riferìssen a la temperadura standard 25 °C.
Poiché l'aggionta de ‘n’acid o d’ona bas a l'acqua l’aumenta o la diminuiss, la concentrazion di ioni [H3O+] rispètt al valore de la neutralità, ona soluzion (a 25 °C) la se ciamarà:
- Acida quand che [H3O+] > 10−7 M
- Neutra quand che [H3O+] = 10−7 M
- Alcalina quand che [H3O+] < 10−7 M
‘Na manera pussée sempliz de esprìmm l'acidità o alcalinità d’ona soluzión a l’è la funzion pH, descrivùda in de l'introduzion. L'utilizzazion de la funzión pH a l’è molto ùtil, de già che la permètt de restrèng l’intervàll in su ‘na scala de valór numerich. Donca l’utilizzazion de la funzion pH la permètt de dì che (a 25 °C) ’na soluzion a l’è:[3]
- Acida se el pH l’è < 7
- Neutra se el pH l’è = 7
- Basica se el pH l’è > 7.
Ona misura fada a la svèlta del pH a l’è possibil cont i inscì ciamàd cartinn indicador universal, ch'a hinn di fass suttil o di naster de carta ingravidàd d’ona mes’ciada de divèrsi indicador. Quand che hinn sùcc a hinn de colór giald, ma quand che vegnen espòst a ‘na soluzion acquosa àcida o basica cambien el so colór in funzion del pH de la soluzion:
- Vioeula/ross scur = acidità estrèmma (pH 0)
- Ross = acidità elevada
- Arancion = acidità media
- Giald = acidità débol
- Giald che ‘l tend al verd = acidità minima
- Verd = neutralità perfètta (pH 7)
- Verd che ‘l tend al bloeu = alcalinità minima
- Azur = alcalinità dèbol
- Bloeu = alcalinità media
- Bloeu scur = alcalinità elevada
- Endegh = alcalinità estrèmma (pH 14)
pOH
[Modifega | modifica 'l sorgent]
A l’instèssa manera a se po’ introdù el pOH:
- pOH = -log10[OH-]
L’utilizzazion del pH e del pOH la permètt de esprimm el prodòtt iònich de acqua in quèlla manera chì:
- pH + pOH = 14
Quèlla relazión chi l’insegna che ind ona soluzion acquosa a 25,00 °C la sòma del pH e del pOH la gh’hà de vèss semper eguàl de 14. S’a se conòss el pH (o el pOH) a l’è possibil de risalìgh ai concntrazion [H3O+] e [OH-], per mèzz de quèj espression chì:
- [H3O+] = 10-pH; [OH-] = 10-pOH
IA l'istèssa manera del pOH, del pH, ancasì a se definìss ‘me logaritm decimal negativ de la concentrazion di ion in soluzion, e ‘l ven indicàa inscì:
- .
La concentrazion l’è misurada in mòl / liter de soluzion, e l’è ciamada concentrazion molar. Se per esempi ‘na soluzion acquosa la gh’ha ’n pH pari a 3,5, dai definizion el sortìss foeura che la concnetrazion di ion a l’è quèsta chì:
- mol/L.
Standard per la misurada del pH
[Modifega | modifica 'l sorgent]El standard internazionàl accettàa a l’è ‘na soluzione acquosa 0,05 M ( M= mòl per liter) de idrògenoftalaa de potassi, che ‘l sò pH a 25,00 °C l'è stà misuràd con el valor de pH = 4,005.
De tutt i maner a hinn stàa definìi tanti alter standard segondari, che ‘l sò pH a l’è stàa misura con la cura màssima possìbil rispètt al pH standard principàl.
Il pH in del calibrà l'elettrodo a veder
[Modifega | modifica 'l sorgent]De già che a gh’è disponibil on grand numer de standard segondari, a l’è possibil de doperà in del calibrà l’elettrodo a veder on stadard che ‘l gh’hà on pH arent a quèll de la soluzion de vèss misuràa, oppur, l’è mèj de doprà du standard che gh’hànn di pH pòch superior o inferior a quèll de misurà, de manera de minimizzàa on possibil contegn "minga ideàl" de l'elettrodo medésim. El pò defàtt succed che la pendenza de la rètta che liga insèma la fòrza elettromotrìs de la cèllula de misurà el pH la sia leggerment divèrsa del valór "Nernstiàn" (), pari a 59,16 mV a 25,00 °C.
pH de viragg
[Modifega | modifica 'l sorgent]A l’è ciamàa pH de viràgg el valor del pH che ‘l correspónd al cambi de color de on indicador: quèll valór chì a l’è donca ùtil in del determinà qual è l’indicadór che l’è pussée giust de vèss doperà per fà 'na titolazion infra on acid e ‘na bas. Defàtt el pH de viràgg el doarìss correspònd al pont de equivalenza, quand che i equivalent di du component hinn eguàl in numer.
Proton acid in di compòst organich
[Modifega | modifica 'l sorgent]
In di compòst organich, de sòlit i proton ligàa cont i atom de carbòni gh’hànn 'n acidità bassa, tuttmanch on quaj proton l'è bon de destaccàss de la molecola a la fàcil (de chi la soa acidità). Ancaben l'acidità la sìa nò paragonàbil cont on àcid fòrt (pKa<1) el fenòmen el diventa important quand che sti chì vànn in contàtt cont ‘na bas che la gh'abìa 'na fòrza tal de ciapànn via el proton. Quèll aspètt chì a l’è de interèss perché i reazion àcid-bas hinn importànt ind la chimica organica.
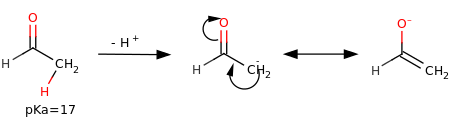
Chi de sora a vènn fàa vedée el destàcch de on proton alfa de on carbonil, con pKa=17, che rispètt a l’acidità di proton de on alcan (pKa≈50) a l’è molto pussée bassa. El distàcch in quèll caso chì el po’ vèss spiegàa cont el notà che ‘l carbanión el s’è stabilizza per mèzz de ‘na risonanza, in particolar ‘na tautomeria cheto-enòlica.[4]
Nòta per completèzza
[Modifega | modifica 'l sorgent]La scala internazional del pH a l’è basada in su di concentrazión esprèss in mol/kg al pòst de mol/L. A l’è inscì perchè i concetrazion pòden vèss misuràd in tèrmen de volùmm. De tutt i maner ind la pupart di aplicazion prategh quèlla differenza chì 'è senza importanza.
Nòt stòrich e etimològich
[Modifega | modifica 'l sorgent]Quant a l'etimologìa del tèrmen pH a l’è vegnuda foeura ‘na questión. Second quajvun la "p" l’indicarìss domà l’operadór matematich descrivùu adèssadèss, a gh’è di alter che pensen inveci che ‘l staga per "pondus" ("pes" in latin), oppur "power" (potènza in inglése). Quèj trii interpretazion chì hinn però putòst irragionévol vist che ‘l Sørensen l’hà pubblicàa domà in sti trii lenguv chì: todèsch, francès e danés. A l’è interessant de notà che ‘l Sørensen, despèss, l’ha dopràa la "q" inscambi de la "p" per designà l'elettrodo de riferiment (a idrògen).
Al princippi el Sørensen l’hà dopràa ‘me simbol "Ph", che poeu l’è diventà "PH" e domà in di ann 20 l’è diventàa "pH" a la definitiva, ‘doe "p" el gh’ha la nòta funzion de operador matematich.
Nòt
[Modifega | modifica 'l sorgent]- ↑ Silvestroni, p. 424.
- ↑ (EN) IUPAC Gold Book, "pH"
- ↑ Silvestroni, p. 425.
- ↑ Ch21: Acidity of alpha hydrogens
Bibliografia
[Modifega | modifica 'l sorgent]- Paolo Silvestroni, Fondamenti di chimica, 10a ed., CEA, 1996. 88-408-0998-8.



![{\displaystyle a_{H^{+}}=\gamma {\frac {[H_{3}O^{+}]}{C_{H^{+}}^{0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3d4cad14b6bd0dab156faf9219cf12c0c451b29)
![{\displaystyle [H_{3}O^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/16f048721398f4ee57fcd410f0ec4f4a1e3846d5)


![{\displaystyle pH=-\log _{10}{\frac {\left[H_{3}O^{+}\right]}{C_{H^{+}}^{0}}}=\log _{10}{\frac {C_{H^{+}}^{0}}{\left[H_{3}O^{+}\right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c5d44580fe44c0bddfeebcb356e2e807393a2d3)
![{\displaystyle pH=-\log _{10}[H_{3}O^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8c0d937fa8a6fdad879aa15a464fd2c9ef9b1f6)

![{\displaystyle K_{w}=[H_{3}O^{+}][OH^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/304d912d3773d702f8d6c37ea78a6321c6396065)

![{\displaystyle pH=-\log _{10}[H^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/645372dffba272d2e09a6da6aff7063616b46270)
![{\displaystyle [H^{+}]=10^{-3.5}=3.16\cdot 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5892005732171b76ab090037544785ae84ffa530)
